|
|
 Nichtlineare Spektroskopie an kovalent gebundenen Chromophoren an Peptiden und Kohlenhydraten
Nichtlineare Spektroskopie an kovalent gebundenen Chromophoren an Peptiden und Kohlenhydraten
_k.jpg)
|
Interdisziplinäre Zusammenarbeit mit der AG Pflanzenphysiologie im Institut für Biochemie und Biologie unserer Universität
Fragestellung:
- Aufklärung von Elektronen- und Energieübertragungsprozessen in Pigmentsystemen, z.B. den lichtsammelnden
Komplexen des pflanzlichen Fotosynthesesapparates mittels transienter - z.B. "Excited State Absorption"
(=ESA) -Spektroskopie im Femtosekundenbereich
- Erfassung von Änderungen der räumlichen Struktur von Proteinen, also von konformativen Änderungen und
Faltungsprozessen bzw. Zuständen mittels ESA
Motivation: Veränderungen in der 3D-Struktur von Proteinen sind wesentliche Prozesse in der Natur, z.B.
als Bestandteil enzymatischer Reaktionen. Fehlfaltungen können zu Aggregationen führen, wie z.B. bei den
Prion-Proteinen. Native Faltung ist Voraussetzung für funktionelle Interaktion mit anderen Proteinen.
|
Ergebnisse:
Es wurden ein kleineres monomeres Protein und ein Fluoreszenzmarker, dessen ESA erfasst werden kann,
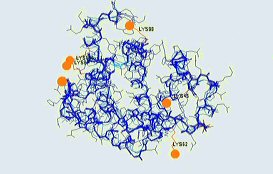
ausgewählt. Das Modellsystem aus dem Protein Myoglobin (roter Muskelfarbstoff, Sauerstoffüberträger, vergl.
Ribbon-Modell) und dem Fluoreszenzfarbstoff Fluorescein-isothiocyanat (FITC) wurde synthetisiert, gereinigt
und mit verschiedenen Methoden charakterisiert.
Synthese: Die Kopplungsprodukte sind hinsichtlich der Anzahl der Fluorophore pro Proteinmolekül und deren
Lokalisation am Protein chemisch heterogen (Nachweis über UV/VIS-Spektroskopie, HPLC,
MALDI-TOF-Massenspektrometrie). Bevorzugte Kopplungsstellen sind die Lysinreste 45, 62, 87, 98, 145 und der
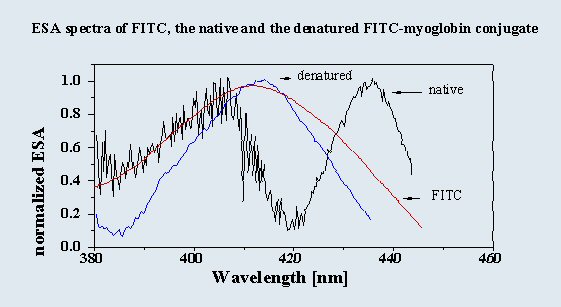
N-Terminus (vgl. Bild) ESA-Spektroskopie: Die ESA-Spektren nativer Kopplungsprodukte weisen zwei Maxima auf
(bei ca. 405 und 435 nm). Das ungebundene Fluorophor wie auch der denaturierte Protein-Fluorophor-Komplex
besitzen ein einziges Maximum bei 410 nm (vgl. Grafik). Somit ist die Fluorophorpopulation im nativen Protein
auch photophysikalisch verändert, und wie sich durch Vergleich mit Fluoreszenzabklingdaten ergibt, auch
heterogen.
|
|
| |
|
|
Schlußfolgerung:
Extern gebundene Fluorophore sind als Reporter ihrer Proteinumgebung geeignet. Dies spiegelt sich in ihren
ESA-Spektren wider.
|
|
|
|
|
|
Sekretariat
|
|



 English
English


